
Szabó Gál Bence
Szakmai vezető
Mi lenne, ha megtudnád, hogy a mezei K1-vitamin is épp oly jó, tán még jobb is, mint a drága K2, csak senki nem beszél róla? Ismered Dumas Vasálarcos sztoriját, amiben két ikerkirályfi közül az egyiket vasálarcban elrejtik, míg a másik uralkodik? No, hát valami ilyesmi van a K-vitaminokkal kapcsolatban is: A K1 vasálarca, hogy ő csak a véralvadást szabályozza és jól el van rejtve a figyelem elől és ha elő is kerül, akkor valami méltatlan vizsgálatra hivatkozva... Mind állati-, mind humán vizsgálatokban hozta a K2 hatásait, összehasonlításokban meg rendre kenterbe is verte a K2-t, mégsem hallunk róla, ahogy arról sem, hogy a modern nyugati táplálkozás a feldolgozott ipari hústermékek fogyasztása miatt nagyon is K2 dús, míg a természeti népek és őseink táplálkozásában gyakorlatilag nem is volt K2, ellenben K1 akár százszor annyi is. A nyugati ember K1 fogyasztása csökkent le a töredékére és a K2 nőtt meg a sokszorosára a természeti népekhez és őseinkéhez képest.
Szokatlan módon cikkemet az összefoglalójával és konklúziójával (gyakorlati ajánlással) fogom kezdeni, mivel felteszem sokan nem szívesen rágnák át magukat esetleg unalmas részleteken. Akinek meg az összegzés meghozza a kedvét és kíváncsi lesz több részletre, az folytathatja az összefoglaló táblázat alatt az olvasást.
Összefoglalás és gyakorlati ajánlás:
Alapvetően hosszútávon bőségesen elegendőnek tűnik napi 500-1000 mcg K1-hez hozzájutni, legalább közepesen jól felszívódó formában, azaz ha zöldségekből, akkor elegendő zsiradékkal és lehetőleg hőkezelve, míg ha kiegészítőből, akkor olajban oldott vagy emulgeált formából és étkezéskor bevéve, így a felszívódása is 80% körüli és a felezési ideje is elég hosszú.
Egyes gyógyszerek (sztatinok, bifoszfonátok, kumarin-származékok) gátolják a K1 és MK-7 átalakulását K2 MK-4-é, így ilyen esetben érdemes MK-4-et is szedni, legalább napi 1500 mcg-ot. (A kezelőorvossal való egyeztetés után.)
A D3, cink és magnézium fokozza a K1->K2-vé alakulást, ahogy az A-vitamin (retinol) és B6-vitamin a K2 hatását segíti. Ezek megfelelő mennyiségére érdemes odafigyelni.
A szöveteink természetes MK4/K1 arányának megőrzése és így a K-vitaminok hatásának fokozása, valamint a kontraproduktivitás megelőzése érdekében, ha szedünk K2 MK-7-et, akkor legalább 3x annyi K1-et is szedjünk, míg ha szedünk MK-4-et akkor legalább ugyanannyi K1-et is szedjünk, így nem okozhatnak a K2-vitaminok problémát.
A K1 önmagában is biztonságos, és ha az átalakulása nincs blokkolva az említett gyógyszerek által, akkor a K1 a leghatásosabb a K-vitaminok közül.
Ideálisan, napi min.500mcg K1-vitamin szedését javaslom olajban oldott vagy emulgeált formában, de inkább 1000mcg-ot. E mellé opcionálisan 100-200mcg K2 mk-7 szedését is javaslom, de nem többet. K1-vitmainból 1000mcg feletti mennyiséget is érdemes lehet szedni, napi 5mg ideálisnak tűnik, mivel egy vizsgálatban ez a mennyiség (2-4éven át szedve) negyedére csökkentette a rákkockázatot és felére a töréskockázatot.
| K1-vitamin (Fillokinon) | K2 MK-4 (Menakinon-4, avagy menatetrenone | K2 MK-7 |
Egyéb LC-MK |
|
|---|---|---|---|---|
| Átlag nyugati táplálkozásban /nap | 50-100 mcg | 20-100 mcg (ipari feldolgozott húsárukból főleg) | 0-5 mcg (Japán: ~50 mcg) | 20-1000 mcg (ipari feldolgozott húsárukból főleg) |
| Egy egészség tudatos táplálkozás jellemzően ennyit tartalmaz /nap | 200-1000 mcg (zöldségekből, olívából, magvakból, olajokból, májból) | 5-10 mcg („bio” húsokban kevés van) |
0-10 mcg (Japán: ~100 mcg) |
0-10 mcg (fermentált zöldségekből és sajtokból, „bio” húsokban nincs) |
| Mai élelmiszereinkkel életszerűen és még viszonylag kényelmesen bevihető max. mennyiség | Kb. 2500 mcg | Kb. 100 mcg (ipari húsárú) | 200 mcg (natto) | 2000 mcg (ipari húsárú) |
| Természeti népek táplálkozásában, illetve az evolúciónk során, azaz a paleolitikumban fogyasztott becsült mennyiségük /nap |
Természeti népek: kb. 1000 mcg vagy több. Őseink: 1000 mcg – 1millió mcg közt |
10-100 mcg | Nulla | Nulla, kivéve rendszeres széklet fogyasztás esetében |
| Fölszívódás/biológiai hasznosulás élelmiszerekből | 10-80% (főzés/sütés és zsiradék hozzáadása fokozza) | 600 mcg-ig nulla, míg 600 mcg felett kb. harmada a K1-hez képest | 75-100% | Feltehetően az MK-7-hez hasonlóan magas |
| Fölszívódás/biológiai hasznosulás olajban oldott vagy emulgeált étrend-kiegészítőkből zsiradékban elégséges étkezéssel bevéve | ~80% | 600 mcg-ig nulla, míg 600 mcg felett kb. harmada a K1-hez képest | 75-100% | Feltehetően az MK-7-hez hasonlóan magas |
| Felezési-idő étkezéskor bevéve | kb. 6-7 óra | kb. 4 óra | Elsődleges felezési idő 6-7 óra, másodlagos kb. 2 nap | MK-7-hez hasonló, de a másodlagos felezési idejük még hosszabb |
| Előfordulásuk és arányuk az állati és emberi szervekben és szövetekben | Minden szövet tartalmazza. A csont, szív és máj főleg K1-et tartalmaz. | Legtöbb szövet tartalmazza. Agy, vesék, artériák és herék főleg MK-4-et tartalmaznak. | Természetes körülmények közt nem fordul elő szövetekben, de a máj raktározhat belőle | Természetes körülmények közt nem fordul elő szövetekben, de a máj raktározhat belőle |
| Szervezetben lévő arányuk | Kb. 10-30% (azért ilyen alacsony, mert már felszívódás során is jelentős részben átalakul K3-vitaminná, majd a szövetekben MK-4-gyé) | Kb. 70-90% (minden K-vitamin MK-4-gyé alakul a szövetekben, kivéve, amit direkt meghagy a szervezet K1 formában) | Kb. 0% (nincs rá szükség, ezért mindet átalakítja a szervezet K3-má, majd MK-4-gyé, különben nem tudna hatni) | Kb. 0% (nincs rá szükség, ezért mindet átalakítja a szervezet K3-má, majd MK-4-gyé, különben nem tudna hatni) |
| Nagy dózisuk képes-e felborítani a természetes szöveti K-vitamin egyensúlyt (K1/MK4) | Nem | Enyhén | Igen | Igen |
| A májban lévő VKD-k /véralvadási faktorok aktiválásában mennyire jó? („Túlaktiválni” nem lehet, az a jó, ha mindet aktiválja) | Nagyon jó (kb. 100 mcg elég teljes aktiváláshoz) | Képes rá, de nem jó benne. | Nagyon jó (kb. 30-40 mcg elég a teljes aktiváláshoz | MK-7-hez hasonlóan, talán még jobban |
| Oszteokalcint aktiváló hatás (csontozatra gyakorolt pozitív hatás mutatója) | Nagyon jó (már 250 mcg is közel mindet aktiválja, de 500-1000 mcg teljesen) | 600 mcg alatt nincs hatása. 1500 mcg már jól aktiválja, de még 45ezer mcg MK4 sem olyan jól, mint 1000 mcg K1 | 90 mcg már aktiválja, de magas dózisai sem olyan jól, mint a K1. | Sosem mérték emberen |
| MGP-aktiváló hatás (szív-érrendszerre/meszesedésre gyakorolt pozitív hatás mutatója) | Nagyon jó: 500 mcg-ja közel teljesen aktiválta (legmagasabb mért aktiválás) | Nincs vizsgálat | Jó, de elmarad a K1-től | Sosem mérték |
| Epidemiológiai vizsgálatokban megfigyelt általános betegség-kockázat csökkentő hatás (pontosabban all-cause mortality) | Igen (400 mcg felett) | Nem (csak invalidnak bizonyult mérésekben) | Nem (csak invalidnak bizonyult mérésekben) | Nem (csak invalidnak bizonyult mérésekben) |
| Epidemiológiai vizsgálatokban megfigyelt CVD/CAC/CHD megelőző hatás | Igen (400 mcg felett) | Nincs (csak invalidnak bizonyult mérésekben) | Nincs (csak invalidnak bizonyult mérésekben) | Nincs (csak invalidnak bizonyult mérésekben) |
| Epidemiológiai vizsgálatokban megfigyelt pozitív hatás csontozatra | Igen (400 mcg felett) | Nincs | Nincs (csak invalidnak bizonyult mérésekben) | Nincs (csak invalidnak bizonyult mérésekben) |
| Placebó-kontroll vizsgálatokban bizonyított pozitív hatás csontozatra | Igen, jelentős (100-200 mcg, 500, 1000 és 5ezer mcg-os dózisainál is bizonyított hatás) | Igen, jelentős (min. 1500 mcg-os dózisban, de inkább 45ezer mcg-os dózisaiban) | Igen, 100 és 180 mcg-os dózisban | Nincs vizsgálat |
| Placebó-kontroll vizsgálatokban bizonyított pozitív hatás kardiovaszkuláris rendszerre | Igen, hatásosnak találták az összes RCT vizsgálatban, ahol nézték. (3/3) | Nem (3/0), illetve alig: egyetlen vizsgálatban találták picit hatásosnak, de ott is csak a súlyosan K-vitamin hiányos alanyoknál a szokásos giga dózisban. | Nem-igen :) 1 db vizsgálat egy alcsoportjában 180 mcg-os dózisban picit igen, de a teljes csoportra nézve nem, azaz nem volt hatásos egyetlen vizsgálatban sem végső soron. | Sosem vizsgálták |
| Placebó-kontroll vizsgálatokban bizonyított pozitív hatás a koszorúerek elmeszesedésének megelőzésében | Igen, hatásosnak találták több vizsgálatban is. | Hatástalannak találták az összes vizsgálatban | Hatástalannak találták az összes vizsgálatban, sőt a legfrissebb vizsgálatban 360 mcg-os napi dózisát még károsnak is találták, ugyanis fokozta a meszesedést a placebóval szemben. | Sosem vizsgálták |
| Jelentős rákkockázat csökkentő hatás placebó-kontroll vizsgálatban | Igen, 4 éven át napi 2 mg szedése 75%-kal csökkentette a rák előfordulását. | Igen, de csak 45 mg-os vagy feletti dózisoknál. | Nem | Nem |
| Humán intervenciós vizsgálatban igazolt májrák progresszióját és/vagy kiújulását csökkentő jelentős hatás | Igen | Igen | Nem | |
| Humán intervenciós vizsgálatokban májdaganat méret csökkenést kiváltó hatás | Igen (50 résztvevő, kb. 80%-uknál stabilizálta vagy javította az állapotukat, többeknél tumorméret csökkenést indított el…) | Nem (azonban egy leukémiás betegeken végzett vizsgálatban teljes gyógyulás is előfordult) | Nem | Nem |
| Életszerű dózisban szedve is hatásos-e? |
Igen |
Nem | Igen, de 360 mcg már kontraproduktívnak tűnik (persze 200 mcg feletti dózis már nem is életszerű) | Nem vizsgálták, de feltehetően az MK-7-hez hasonló ebben is. |
| Találtak-e bármilyen human vizságlatban negatív vagy kontraproduktív hatást a szedésétől? | Nem, sosem. | Igen, egy humán és egy preklinikai vizsgálatban is | Igen, humán és preklinikai vizsgálatban is. | Nem vizsgálták sosem a hatásukat. |
| Összességében mennyire hatásos és mennyire biztonságos. | Nagyon hatásos mindenben. Nagyon biztonságos bármilyen dózisa. | Csontozatra nagyon hatásos, szív- érrendszerre nem. Biztonságos, bár az igazán hatásos napi 45 mg-os dózisával enyhe aggályok merülnek fel. | Csontozatra hatásos, szív- érrendszerre nem igazán. 200 mcg-os dózisáig hatásos és biztonságos teljesen. 360 mcg már kevésbé hatásos és káros lehet. | Sosem vizsgálták, de MK-7-hez hasonló lehet. |
| A hatásos dózis ára | filléres | drága |
közepesen drága |
szinte ingyen |
| Ár /mg | 1x | 10x | 100x | 0,1x |
| EU-ban engedélyezett? | Igen | Nem | Igen | Nem |
| Statin, kumarinok vagy bifoszfonát típusú gyógyszerek szedése gátolja-e a hatását? | Igen | Nem | Igen | Igen |
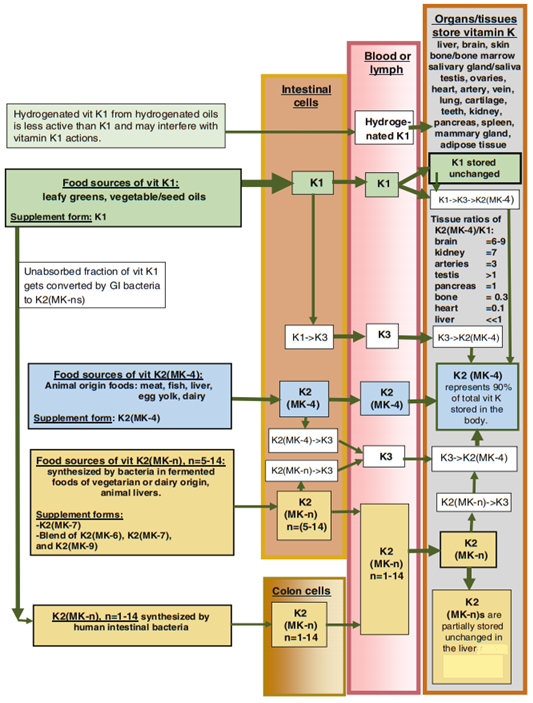
Egy remek ábra K-vitaminok átalakulásáról a szervezetben a Textbook of natural medicines 2020-as 5. kiadásának Pharmacology of natural medicines kötetének K-vitaminnal foglalkozó fejezetéből:
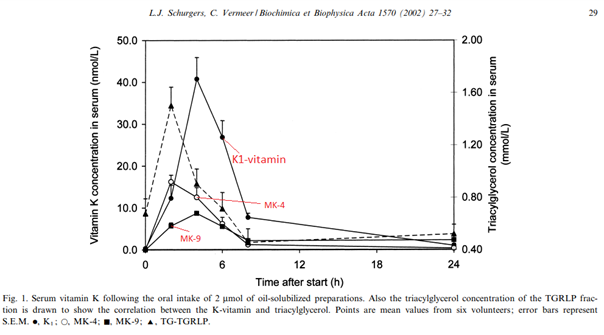
És egy remek ábra, amely 900 mcg K1 + 900 mcg MK-4 + 1600 mcg MK-9 felszívódását mutatja egészséges embereknél egy reggeli vajaskenyér vajában oldva elfogyasztva:
Az olvasási idő innen még körülbelül 75 percet vesz igénybe. Megértjük, hogy ha nincs ideje vagy kedve ennyire elmélyülni e témában, így készítettünk az írás maradék részéből egy 12 perces, rövidített változatot is,
amelyet ide kattintva olvashat el.
K-vitaminok formái
K3-vitamin (menadion) – Élelmiszerekben nem fordul elő, de minden K-vitamin, legyen az K1 vagy K2, részben vagy egészben K3-má bomlik a szervezetben, majd ebből alakulnak át K2-vé. Egy átmeneti forma tehát, amit nem használnak élelmiszerekben, de mivel ritka hatékonyan növeli a szervezet K2-vitamin szintjét (kb 2x hatékonyabban, mint a K1 vagy K2) és filléres, még a K1-nél is sokkal olcsóbb, ezért mega-dózisban használják ipari körülmények közt nevelt állatok tápjában, normál dózisban pedig egyéb tápokban, pl kutyatápokban. Húsok, májak K2-vitamin tartalma a megadózisú K3-tápozás miatt tud magas lenni.
K1-vitaminnak 1 féle formája van, a fillokinon.
A K2-vitamin csupán egyetlen formája található meg jellemzően állati és emberi szervezetben normál esetben, a menakinon-4 (MK-4). Kis mennyiségben ennél hosszabb láncú menakinonok is megtalálhatóak egyes esetekben az ember és állat májában, melyek a bélbaktériumok által alakulnak K1-vitaminból és a májban tárolódnak. Ilyen a menakinon-7 is (MK-7), de MK-5 és MK-14 közt mindet termelik a baktériumok a belekben.
Élelmiszerek közül a K1-vitamin növényi élelmiszerekben gazdagon megtalálható, de állati élelmiszerekben is, csak kisebb mértékben. K2 pedig gyakorlatilag az érlelt sajtokon, fermentált szóján (nattó) és mega-dózisú K3-vitaminnal dúsított táppal etetett állatokból készült élelmiszereken kívül nem fordul elő élelmiszerekben, csak nyomokban.
K-vitaminok megközelítése a természeti népek és őseink táplálkozásából kiindulva
A természeti népek táplálkozásában a K1-vitamin bőségesen előfordul (átlag kb. napi 1000 mcg). Ezen felül a kelet-afrikai óceánpartnál végbement meghatározó „vízimajom” evolúciós szakaszunkban évmilliókon át extrém magas K1-vitamin tartalmú „tengeri zöldségeket” is fogyaszthattunk, melyekből akár 1millió mcg/nap mennyiséget is megközelítő K1-hez juthattunk hozzá (ráadásul ezek O3 DHA tartalma is magas). Akár így volt, akár nem, a mai modern táplálkozásban bő tizedére csökkent a K1-vitamin bevitelünk, a természeti népre jellemzőhöz képest. Ezzel szemben K2-vitamin bevitelünk kb 10-100x-osára nőtt, ugyanis a K2-nek gyakorlatilag csak pár száz éve létezik élelmi forrása: messze a leggazdagabb forrásai a sajtok, a fermentált szója, de különösen a modern feldolgozott és egyéb húsipari termékek. Szabadon tartott és vadon élő állatok semmilyen részében sem mértek még 10 mcg/100 g feletti K2 tartalmat, de inkább csak 1-2mcg/100 g a jellemző. Olyan mérésekben mértek csak magas K2 tartalmat állati élelmiszerben, ahol az állat természetes táplálkozásához képest kb. 100x-os K-vitamin mennyiséget kaptak a tápjukkal (ilyenkor szintetikus K3-mal dúsítják mega-dózisban a rossz minőségű tápokat, mivel ez sokkal olcsóbb megoldás, mint rendesen táplálni őket) és esetleg mellette a rossz tartás miatt székletevés is jellemző lehetett ezeknél az állatoknál. (A székletnek nagyon magas a K2 tartalma, ha magas a K-vitamin bevitel és így az ürülék elfogyasztása nagyon megnöveli a K2 szintet a húsban és minden szövetben). Az ilyen iparilag nevelt sertésekből készült élelmiszerek egy friss mérés szerint 300-500 mcg K2-t tartalmaznak /100 g, míg a friss húsuk is akár 100 mcg K2-t, főleg MK-8/9/10/11 formában, melyek a székletben is dominálnak. A K3-mal dúsított kukoricával tömött libamájából készült májpástétom is közel 400 mcg K2-t tartalmaz, de MK-4 formában (tömött liba nem eszi vissza a székletét), míg a combhúsában is 30 mcg MK-4 (csirkecombban is mértek már 60 mcg/100 g-ot). Azaz a mega-dózisú K3 dúsítás gyakorlata az iparban magas K2 szintet eredményez a modern, tápos húsárukban. Feltehetően, ha a nevelt állat nem nagyon eszi vissza másik állat vagy a saját ürülékét, akkor magas MK-4 szintet eredményez a sok K3, míg ha gyakran eszi, akkor olyan sok nagyon hosszú felezési idejű MK-8-11-hez jut hozzá ürülékfogyasztással, hogy azok túldominálják a húsban az MK-4-et.
Bárhogy is, az elég egyértelműnek tűnik, hogy semmilyen évezredekkel ezelőtt is létező élelmiszernek nem igazán lehetett 10 mcg/100 g feletti K2 tartalma, hacsak nem fogyasztottunk székletet (pl. a hadzák néha csinálnak keményítős gumókkal és fűszerekkel összefőzött állati ürülékből levest). A székletfogyasztáson kívül azonban K2-höz csak MK-4 formában juthattunk hozzá és valószínűtlen, hogy akárcsak a napi 100 mcg K2 bevitelt megközelíthettük volna, ami annyi, mint a semmi, ugyanis az MK-4-nek 600 mcg alatti dózisban nincs hatása és feltehetően el sem éri a véráramot. A nagyon kevés növényi élelmiszert fogyasztó, szinte csak állati élelmiszeren élő yupik inuitok pl különösen K-vitamin hiányosnak bizonyultak, sokszor még a véralvadási faktoraik megfelelő működtetéséhez sincs elég K-vitamin a szervezetükben.
Összegezve tehát a modern ember K1 fogyasztása töredékére csökkent, míg K2 fogyasztása sokszorosára nőtt.
Ez azért is lehet meglepő, mert az emberi és állati szervezet is több MK-4-et tartalmaz, mint K1-et, egyéb K2-t meg semennyit. Ebből az következik, hogy a sok K1 önmagában is elég a szervezet optimális K2 szintjének biztosítására. Hogy is van ez?
Bármilyen K-vitamint is nyelünk le, annak jelentős része már a felszívódása során átalakul K3-má a bélsejtekben (még ha MK-4-et is fogyasztottunk, az is átalakul előbb K3-má részben vagy egészben). Az így K1-ből és K2-ből létrejött K3 a vérárammal eljut a szövetekhez, ahol egy UBIAD1 nevű enzim K2 MK-4-é alakítja őket (a K3-mat). Ami pedig nem alakult át K3-má, hanem változatlan formában jut el a szövetekhez és úgy is épül be, azt később a szövet a saját igénye szerint alakítja K3-má, majd MK-4-gyé, de ez már sokkal lassabban következik be, mivel az UBIAD1 enzim át tudja ugyan a K1-et is alakítani K3-má, de inkább a K3->MK-4 konverzióban jeleskedik. Ezen felül a máj is képes átalakítani a K1-et K2 MK-4-gyé (ezt a D3-vitamin fokozza). Sőt, a K1 esetében a föl nem szívódott részből is alakul K2! A bélbacik a mai nyugati emberekben mérve is a K1-vitamin közel 100%-át átalakítják K2-vé (MK-8/9/10 stb), melyből ugyan nem sok jut a májnál tovább vissza a véráramba, de ez feltehetően részben az alacsony koncentrációja miatt van -> magasabb K1 bevitellel a koncentráció fokozható és így visszajuthat több K2.
A lényeg tehát, hogy sok ismert mechanizmus biztosítja az emberben/állatban a K1->K2 konverziót. Jó pár vizsgálatot végeztek, melyekből azt a következtetést lehet levonni, hogy az emberben és egérben egyaránt hatékony a K1->K3->MK-4 konverzió, ahogy a belekben való K1->K2 (MK-8,9,stb) termelés is. Egy vizsgálatban egészséges embereknél megpróbálták megállapítani, hogy kb. mennyi alakulhat át szájon át bevett nagy dózisú K1-ből K3-má, majd K2-vé a felszívódása után 24 órán belül és arra jutottak, hogy a bevett dózis 8-30%-a, mely átszámolva a felszívódott dózisra kb. 50%-os átalakulást jelent, amiben még nincs benne, hogy később a szövetekben, majd a bélbaktériumok által is átalakul.
A szöveteknek megvan a saját, számukra ideális K-vitamin arányuk (MK-4/K1). Bennük a K1 K2-vé (MK-4) tud alakulni, de van szövet, ami nem alakítja át mindet, mert a K1-et preferálja. Mivel a K2 nem tud K1-é alakulni, ezért a túlzott dózisú K2 föl tudja borítani az arányt, míg a K1 nem tudja. A K1 a szövetekben a szövetekre jellemző ideális MK-4/K1 arány fenntartása mellett növeli a K2 szintet ugyan olyan mértékben, mint maga a K2 MK-4.
Hasznosulás
A K2 MK-7 hasznosulása a legjobb, a bevett dózis közel egésze hasznosul, míg a K1-vitaminnak csak max.80%-a. Az MK-4 600 mcg alatti dózisaiban feltehetően egyáltalán nem hasznosul, míg 1000 mcg-os dózisban szedve vajban oldva kb. harmadannyira hasznosul, mint az azonos módon beszedett K1. A leggyorsabban az MK-4 ürül ki a vérből (felezési ideje kb. 4óra), míg a K1 és K2 MK-7 és MK-9 felezési ideje olajban oldva, étkezéskor szedve kb. 6-7óra, azonban az MK-7 és MK-9 esetén van egy másodlagos felezési idő, azaz miután a felére-negyedére esik a szintje, az onnantól már csak 2 naponta feleződik tovább. Mindez kb. annyit jelent, hogy 200 mcg MK-7 hatása kb. 600 mcg K1-nek felel meg és 1800 mcg K2 MK-4nek, amennyiben elfogadjuk, hogy a K1 és MK-7 is szükség szerint képes átalakulni MK-4-gyé (azaz a K1-nek nem kell mindnek, hiszen ő K1-ként is kell a szöveteknek, nem csak MK-4-ként, azonban az MK-7-nek fontos mind átalakulnia és pont ezért lehet probléma, ha túl sokat szedünk K2-t, K1 nélkül).
Ha mindez így van, ahogy eddig írtam, akkor hasonló vagy jobb állapotjavító és betegségkockázat-csökkentő hatást kell, hogy mutassanak a K1-gyel végzett vizsgálatok is, mint a K2-vel végzettek, különösen a direkt K1-et a K2-vel összehasonlító vizsgálatokban. És pontosan ez is a helyzet! Mielőtt rátérnék a puding próbájára, nézzük meg, hogy milyen vizsgálatokra szoktak mutogatni a K1-gyel kapcsolatban, hogy az nem hatásos:
- In-vitro vizsgálatok: Ezt nem kell kommentálni, hiszen a K1 nem tud K2-vé alakulni, csak élő szervezetben…
- Rotterdam-study és társai: Ezek epidemiológiai vizsgálatok, azaz csak korreláció kimutatására képesek, ok-okozati viszony feltárására nem. Néhány ilyen vizsgálat azt találta, hogy akiknek a legmagasabb volt egy kérdőíves teszt alapján az ínyenc sajt fogyasztása (ami K2 forrás), azok közt ritkább volt egyes kardiovaszkuláris kockázatok száma, mint azok közt, akiknek a legalacsonyabb volt a sajtfogyasztásuk. A különbség 14mcg K2 volt a táplálkozásukban (7mcg MK-9 + 7mcg MK-4). A legkevesebb K1-et fogyasztó csoport kb 150 mcg K1-et fogyasztott, míg a legtöbbet fogyasztók kb 300 mcg-ot. A több K1 csak kevésbé csökkentette a kockázatot, mint a K2, ezért ezekre a vizsgálatokra szoktak hivatkozni, azonban 300 mcg K1-ből, ami nem kiegészítő, hanem pl. zöldség, épp csak picit szívódik föl több, mint amennyi a májnak kell, így nem is meglepő, hogy nem találtak nagy különbséget a nagyon alacsony és extrém alacsony K1-vitamin fogyasztás hatásában. Inkább az a meglepő, hogy mi lehet ezekben a gourmet sajtokban vagy tán csak annyi, hogy aki ínyenc, az kevesebb junk foodot eszik? 2016 óta viszont tudjuk, hogy a feldolgozott húsáruk fogyasztása akár 10-20x annyi K2 fogyasztással jár, mint a nagy sajtfogyasztás, azonban eddig azt közel nullának vették. Emiatt az összes ilyen K2 vizsgálat, ahol az ipari húsáru K2 tartalmát közel 0-nak vették, mind a kukába lehet dobni vagy utólag átszámolni. És mindegyik vizsgálat ilyen. Később aztán egy pontosabb megrendezésű újabb vizsgálatban a görögöknél azt találták, hogy a magasabb (átl.600 mcg) K1 bevitelű résztvevőknél a felére csökkent még több fajta kardiovaszkuláris probléma, mint a Rotterdam study-ban, sőt, a rákkockázat és az összhalálozás is jelentősebben csökkent… És itt egyszerre vizsgálták a K2-t is a K1-gyel, nem csak külön. A magasabb K2 bevitelt nem találták hatásosnak, holott magasabb volt az is, mint a Rotterdam-study-ban és nagyobb különbségek is voltak, bár mindez semmit nem jelent, hiszen a húsáruk magas K2 tartalmával ebben a vizsgálatban sem számoltak, azaz a K2-re vonatkozó megállapítás itt is helytelen, azonban a K1-re vonatkozó helyes, hiszen megfelelően magas volt a K1 bevitel, melyből már jutott a véralvadási faktorok aktiválásán túl is elég a szövetekhez.
A K1 átalakulását K2-vé gátolják a sztatinok és bifoszfonátok. Az ilyen gyógyszerekkel együtt való szedésével megrendezett vizsgálatokra szintén lehet mutogatni, hiszen itt eltörik a versenyző lábát a megmérettetés előtt: Egy ilyen egér vizsgálatra szoktak is mutogatni, ahol viszont pusztán azt akarták a kutatók bizonyítani, hogy a K1-nek át kell tudnia alakulnia K2-vé (MK-4), hogy az érrendszeri meszesedést gátló hatását kifejthesse. Itt végig egy ilyen átalakulást gátló gyógyszert (Warfarin) adtak, mialatt K1-et vagy K2 MK-4-et adtak az egereknek hónapokon át. A K2 (MK-4) megelőzte az erek meszesedését, míg a K1 nem. Azaz, ha nem engedik átalakulni a K1-et K2 MK-4-é, akkor nincs hatása. (Nem vizsgálták, de biztosra veszem, hogy az MK-7-nek se lett volna hatása, hiszen annak is át kell alakulni MK-4-é). Később egy másik vizsgálatban súlyos aorta- és koszorúérelmeszesedéssel rendelkező egereknek adtak az átalakulást blokkoló gyógyszer nélkül nagy dózisú (emberre átszámolva kb 50 mg/nap) K1-et vagy K2-t (MK-4). Mindkettő visszafordította és kb. felére csökkentette a meszes lerakódást 6hónap alatt. A K1 lényegesen hatásosabb volt, mint az MK-4, aminek oka az lehet, hogy mint mérték, a szöveteikben az MK-4 adagolás felborította az ideális MK4/K1 arányt, míg a K1 adagolás megtartotta, miközben ugyanannyira növelte az MK-4 szöveti szintet is, mint az MK-4 maga.
Humán vizsgálatok:
Miután feloldottuk az ellentmondásokat, jöjjön a lényeg, azaz visszaigazolják-e a hatást a rendes intervenciós humán vizsgálatok?
Oszteokalcint és MGP- aktiváló hatásuk: A szív/érrendszerre, meszesedésre, fogakra és bőrre való hatás mutatója a vérből, hogy mennyire képes aktiválni az MGP-t egy K-vitamin fajta, míg a csontozatra/fogakra való hatásé, hogy mennyire képes az oszteokalcint. Mindettőt messze a legjobban humán klinikai vizsgálatokban a K1 aktiválta, méghozzá csupán 500-1000 mcg-os dózisban. Hasonlóan jó eredményt semmilyen K2 semmilyen mennyiségével nem tudtak még elérni, illetve 45ezer mcg K2-vel (MK-4) 1 alkalommal majdnem…
Epidemiológiai vizsgálatokat a Rotterdam-vizsgálat kapcsán már említettünk, pedig ennyire se méltóak, irrelevánsak, hisz teljesen rossz adatokkal számoltak, mint az pár éve kiderült…
Csontozatra való hatással foglalkozó placebo-kontroll vizsgálatokban a K1-vitamin 500 mcg-5mg közti dózisai voltak hasonlóan hatásosak, mint az MK-4 45mg-os (=45ezer mcg-os) dózisai. Az MK-7 100-180 mcg közt volt hatásos, bár lényegesen kevésbé, mint a K1 vagy az MK4. Az MK-7 nem, de a K1 és a K2 is képes volt csontritkulást nem csak lassítani/megállítani, de visszafordítani is. MK-4-ről több vizsgálat is van, de mind 45mg-os dózis, míg K1-ből a legmagasabb dózis 5mg volt, amit csontozatra vizsgáltak hosszan. Hogy ennyivel alacsonyabb dózisban is hatásos/hatásosabb a K1, mint a K2 MK-4, az a szöveti arány tartásán túl a jobb felszívódásával is magyarázható.
Szív- és érrendszere való hatások vizsgálatában a K1 volt a leghatásosabb, 0,5-5mg közti dózisaiban, bár az MK-4 45mg-os dózisokban is rendelkezett hatással, de kevesebbel. Az MK-7-et egyetlen vizsgálatban sem találták hatásosnak a meszesedés vagy bármi más kardiovaszkuláris probléma megelőzésére vagy javítására. Sőt, pont a legfrissebb vizsgálatban, ahol az eddigi legpontosabb mérőmódszert használták a kalcifikáció megállapítására, azt találták, hogy 360 mcg K2 MK-7 szedésének hatására 10%-kal nőtt a kalcifikáció az erekben a placebohoz képest, ahelyett, hogy csökkent volna. (Az MK-7 esetében ez már életszerűtlenül magas dózis, ugyanis a világ legmagasabb táplálkozási MK-7 bevitellel rendelkező embereinek is átl. napi 200 mcg alatti az MK-7 fogyasztásuk és ismerve a lassú felezési idejét, ilyen dózis naponta szedve akkumulálódik és eltolhatja a szöveti MK4/K1 szintet).
Fej-fej melletti összehasonlítások
Természetesen korrekten csak úgy szabad összehasonlítani őket, ha fej-fej mellett egy vizsgálatban, azonos megrendezésben és azonos alanyok közt randomizálva vizsgálják őket. Szerencsére 2 ilyen vizsgálat létezik, ami után nem csináltak soha többet, hiszen anyagilag igen fájdalmas a gyártóknak, hogy kiderült, az akár 100x olcsóbb K1-vitamin jobb, mint a drága K2… Az egyik ilyen vizsgálatban napi 45mg K2 MK-4 hatását hasonlították össze napi 1mg K1-vitaminéval. Egyformán teljesítettek, illetve a K1 hajszálnyit jobban (BMD változást mindkettő megelőzte, de oszteokalcint picit jobban aktiválta az 1mg K1, mint a 45mg K2!)
Egy másik vizsgálatban csupán 100 mcg K1-et vagy K2 MK-7-et adtak hozzá egy amúgy 100-150 mcg K1-et tartalmazó táplálkozáshoz. A K1 lényegesen hatásosabban (3x jobban) növelte a gerinc alsó szakaszának csontsűrűségét, mint a K2, míg egyéb hatásaikban megegyeztek, pl. mindkettő csökkentette a lágyszöveti meszesedést.
Végezetül érdemes még megemlíteni a rákkal kapcsolatos vizsgálatokat is: A legerősebb daganatellenes hatása a K3-vitaminnak van, ami ugye bármelyik K-vitaminból kb. egyformán alakul. Emiatt itt is a K1 tűnik a legpraktikusabbnak és tán legjobbnak, hiszen az a legolcsóbb, min.3x jobb a felszívódása, mint a K2 MK-4-nek, és bár az MK-7-nek még a K1-nél is 3x jobb, de egyrészt 100x drágább, másrészt a 360 mcg-os dózisa már kockázatos lehet és itt mg-os dózisok kellenek.
Egy vizsgálatban 4éven át szedettek 440 változókor utáni nővel napi 5mg K1-et vagy placebot. Ez a placebohoz képest a negyedére csökkentette a rákos esetek előfordulását, miközben a csonttörések számát is felére! Ez az egyetlen placebo-kontroll vizsgálat K1 és rák kapcsolatában. Ez nagyjából megegyezik azzal a hatással, amit napi 45mg vagy még magasabb dózisú MK-4 esetében több vizsgálatban is megfigyeltek.
Ezen felül létezik még 1 vizsgálat a K1-ről és a K2 MK-4-ről is, ahol 40-45mg-os vagy magasabb dózisaik tumorméret-csökkenést, vagy akár teljes gyógyulást okoztak. Az egyik K1-es vizsgálatban 50alany kb. 75%-ánál állapot stabilizálódást értek el, míg 15%-uk esetében tumorméret-csökkenést. Végstádiumú májrákos, áttétes, műthetetlen esetek voltak, így ez meglepően jó eredmény.
[A jegyzet borítóképén a natto látható. 100 grammja 900 μg K-vitamint tartalmaz, ami az ajánlott napi beviteli érték 9-szerese.]
-
Saiko IKEDA, Fumiaki HANZAWA, Saki TAKAHASHI, Norie SUZUKI, Kana SANO, Hiroaki ODA, Tomono UCHIDA, Tissue Distribution of Menaquinone-7 and the Effect of α-Tocopherol Intake on Menaquinone-7 Concentration in Rats, Journal of Nutritional Science and Vitaminology, 2018, Volume 64, Issue 6, Pages 391-398, Released December 31, 2018, Online ISSN 1881-7742, Print ISSN 0301-4800, https://doi.org/10.3177/jnsv.64.391
-
Jin S, Sell JL. Dietary vitamin K1 requirement and comparison of biopotency of different vitamin K sources for young turkeys. Poult Sci. 2001 May;80(5):615-20. doi: 10.1093/ps/80.5.615. PMID: 11372711.
-
Open access peer-reviewed chapter Vitamin K2 in Animal Health: An Overview By Jayde O’Neil, Bethany Scarrott, Ragnhild Aven Svalheim, Jonathan Elliott and Stephen J. Hodges Submitted: January 15th 2016Reviewed: April 22nd 2016Published: March 22nd 2017 DOI: 10.5772/63901
-
Open access peer-reviewed chapter Vitamin K2 in Animal Health: An Overview By Jaydn.com/books/vitamin-k2-vital-for-health-and-wellbeing/vitamin-k2-in-animal-health-an-overview
-
Hirauchi, K., Sakano, T., Notsumoto, S., Nagaoka, auTadayoshi, Morimoto, A., Fujimoto, K., … Suzuki, Y. (1989). Measurement of k vitamins in animal tissues by high-performance liquid chromatography with fluorimetric detection. Journal of Chromatography B: Biomedical Sciences and Applications, 497, 131–137. doi:10.1016/0378-4347(89)80012-x
-
https://www.fda.gov/animal-veterinary/safe-feed/vitamin-k-substances-and-animal-feed
-
Schurgers LJ, Vermeer C. (2000) Determination of phylloquinone and menaquinones in food. Effect of food matrix on circulating vitamin K concentrations. Haemostasis. 30(6):298-307
-
Koivu-Tikkanen TJ, Ollilainen V, Piironen VI. (2000) Determination of phylloquinone and menaquinones in animal products with fluorescence detection after postcolumn reduction with metallic zinc. Journal of Agriculture and Food Chemistry. 48(12):6325-31.
-
Rødbotten, R., Gundersen, T., Vermeer, C., & Kirkhus, B. (2014). Vitamin K2 in different bovine muscles and breeds. Meat Science, 97(1), 49–53. doi:10.1016/j.meatsci.2014.01.005
-
Fu, X., Shen, X., Finnan, E. G., Haytowitz, D. B., & Booth, S. L. (2016). Measurement of Multiple Vitamin K Forms in Processed and Fresh-Cut Pork Products in the U.S. Food Supply. Journal of Agricultural and Food Chemistry, 64(22), 4531–4535. doi:10.1021/acs.jafc.6b00938
-
J Philip Karl, Mohsen Meydani, Junaidah B Barnett, Sally M Vanegas, Kathryn Barger, Xueyan Fu, Barry Goldin, Anne Kane, Helen Rasmussen, Pajau Vangay, Dan Knights, Satya S Jonnalagadda, Edward Saltzman, Susan B Roberts, Simin N Meydani, Sarah L Booth, Fecal concentrations of bacterially derived vitamin K forms are associated with gut microbiota composition but not plasma or fecal cytokine concentrations in healthy adults, The American Journal of Clinical Nutrition, Volume 106, Issue 4, October 2017, Pages 1052–1061, https://doi.org/10.3945/ajcn.117.155424
-
Au, Nicholas T et al. “Dietary Vitamin K and Association with Hepatic Vitamin K Status in a Yup’ik Study Population from Southwestern Alaska.” Molecular nutrition & food research vol. 62,3 (2018): 10.1002/mnfr.201700746. doi:10.1002/mnfr.201700746
-
Eaton SB, Eaton SB 3rd, Konner MJ. Paleolithic nutrition revisited: a twelve-year retrospective on its nature and implications. Eur J Clin Nutr. 1997 Apr;51(4):207-16. doi: 10.1038/sj.ejcn.1600389. PMID: 9104571. ] [Loren Cordain: The Nutritional Characteristics of a Contemporary Diet Based Upon Paleolithic Food Groups, JANA Vol. 5, No. 3 Summer 2002 https://thepaleodiet.com/wp-content/uploads/2015/08/The-Nutritional-Characteristics-of-a-Contemporary-Diet-Based-Upon-Paleolithic-Food-Groups-The-Paleo-Diet.pdf
-
Simes DC, Viegas CSB, Araújo N, Marreiros C. Vitamin K as a Diet Supplement with Impact in Human Health: Current Evidence in Age-Related Diseases. Nutrients. 2020;12(1):138. Published 2020 Jan 3. doi:10.3390/nu12010138
-
Thijssen HH, Drittij-Reijnders MJ. Vitamin K status in human tissues: tissue-specific accumulation of phylloquinone and menaquinone-4. Br J Nutr. 1996 Jan;75(1):121-7. doi: 10.1079/bjn19960115. PMID: 8785182.
-
Fu, X., Moreines, J. & Booth, S.L. Vitamin K supplementation does not prevent bone loss in ovariectomized Norway rats. Nutr Metab (Lond) 9, 12 (2012). https://doi.org/10.1186/1743-7075-9-12
-
Yamaguchi, M., Taguchi, H., Gao, Y. H., Igarashi, A., & Tsukamoto, Y. (1999). Effect of vitamin K 2 (menaquinone-7) in fermented soybean ( natto ) on bone loss in ovariectomized rats. Journal of Bone and Mineral Metabolism, 17(1), 23–29. doi:10.1007/s007740050059
-
Sato T, Kawahara R, Kamo S, Saito S. Comparison of menaquinone-4 and menaquinone-7 in rats. Vitamins (Japan) 2007;81:377–381.
-
Okano T, Shimomura Y, Yamane M, Suhara Y, Kamao M, Sugiura M, Nakagawa K. Conversion of phylloquinone (Vitamin K1) into menaquinone-4 (Vitamin K2) in mice: two possible routes for menaquinone-4 accumulation in cerebra of mice. J Biol Chem. 2008 Apr 25;283(17):11270-9. doi: 10.1074/jbc.M702971200. Epub 2007 Dec 14. PMID: 18083713
-
Hirota Y, Tsugawa N, Nakagawa K, et al. Menadione (vitamin K3) is a catabolic product of oral phylloquinone (vitamin K1) in the intestine and a circulating precursor of tissue menaquinone-4 (vitamin K2) in rats. J Biol Chem. 2013;288(46):33071-33080. doi:10.1074/jbc.M113.477356
-
Ala Al Rajabi, Sarah L. Booth, James W. Peterson, Sang Woon Choi, John W. Suttie, M. Kyla Shea, Benchun Miao, Michael A. Grusak, Xueyan Fu, Deuterium-Labeled Phylloquinone Has Tissue-Specific Conversion to Menaquinone-4 among Fischer 344 Male Rats, The Journal of Nutrition, Volume 142, Issue 5, May 2012, Pages 841–845, https://doi.org/10.3945/jn.111.155804 – Megj.: „In conclusion, MK-4 is the predominant form of vitamin K in multiple tissues, but there appears to be a tissue-specific regulation for the conversion of PK to MK-4. To convert PK to MK-4, the phytyl side chain in PK is removed and a geranylgeranyl side chain is added to the MD nucleus, forming MK-4. However, our data do not support the involvement of enterocytes in this conversion.”
-
Nakagawa K, Hirota Y, Sawada N, Yuge N, Watanabe M, Uchino Y, Okuda N, Shimomura Y, Suhara Y, Okano T. Identification of UBIAD1 as a novel human menaquinone-4 biosynthetic enzyme. Nature. 2010 Nov 4;468(7320):117-21. doi: 10.1038/nature09464. Epub 2010 Oct 17. PMID: 20953171.
-
Shearer MJ, Fu X, Booth SL. Vitamin K nutrition, metabolism, and requirements: current concepts and future research. Adv Nutr. 2012;3(2):182-195. Published 2012 Mar 1. doi:10.3945/an.111.001800 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3648719 – Megj.:„ (UBIAD1) that Nakagawa et al. (60) proposed not only catalyzed the well-described prenylation of precursor menadione to MK-4 but might also be responsible for the initial side chain cleavage of phylloquinone or other MK.”
-
https://chrismasterjohnphd.com/blog/2009/04/07/tufts-university-confirms-that-vitamin
-
Fu X, Wang XD, Mernitz H, Wallin R, Shea MK, Booth SL. 9-Cis retinoic acid reduces 1alpha,25-dihydroxycholecalciferol-induced renal calcification by altering vitamin K-dependent gamma-carboxylation of matrix gamma-carboxyglutamic acid protein in A/J male mice. J Nutr. 2008 Dec;138(12):2337-41. doi: 10.3945/jn.108.093724. PMID: 19022954.
-
Yamaguchi M, Kakuda H, Gao YH, et al. Prolonged intake of fermented soybean (natto) diets containing vitamin K2 (menaquinone-7) prevents bone loss in ovariectomized rats. J Bone Miner Metab. 2000;18(2): 71–76.
-
Craciun AM, Wolf J, Knapen MH, Brouns F, Vermeer C. Improved bonemetabolism in female elite athletes after vitamin K supplementation. Int J Sports Med. 1998;19(7):479–484. PubMed PMID: 9839845.
-
Schurgers LJ, Spronk HM, Soute BA, et al. Regression of warfarin-induced medial elastocalcinosis by high intake of vitamin K in rats. Blood. 2007;109(7):2823–2831.
-
Spronk HM, Soute BA, Schurgers LJ, et al. Tissue-specific utilization of menaquinone-4 results in the prevention of arterial calcification in warfarin-treated rats. J Vasc Res. 2003;40(6):531–537
-
Thijssen et al: Menadione is a metabolite of oral vitamin K. British Journal of Nutrition (2006), 95, 260–266
-
Thijssen HH, Drittij MJ, Vermeer C, Schoffelen E. Menaquinone-4 in breast milk is derived from dietary phylloquinone. Br J Nutr. 2002 Mar;87(3):219-26. doi: 10.1079/BJNBJN2001505. PMID: 12064330.
-
Koitaya, N., Sekiguchi, M., Tousen, Y., Nishide, Y., Morita, A., Yamauchi, J., … Ishimi, Y. (2013). Low-dose vitamin K2 (MK-4) supplementation for 12 months improves bone metabolism and prevents forearm bone loss in postmenopausal Japanese women. Journal of Bone and Mineral Metabolism, 32(2), 142–150. doi:10.1007/s00774-013-0472-7
-
Inaba N, Sato T, Yamashita T. Low-Dose Daily Intake of Vitamin K(2) (Menaquinone-7) Improves Osteocalcin γ-Carboxylation: A Double-Blind, Randomized Controlled Trials. J Nutr Sci Vitaminol (Tokyo). 2015;61(6):471-80. doi: 10.3177/jnsv.61.471. PMID: 26875489.
-
Funahashi N, Hirota Y, Nakagawa K, Swada N, Watanabe M, Suhara Y, Okano T. YY1 positively regulates human UBIAD1 expression. Biochem Biophys Res Commun. 2015 May 1;460(2):238-44. doi: 10.1016/j.bbrc.2015.03.018. Epub 2015 Mar 12. PMID: 25772619.
-
Hirota Y, Nakagawa K, Sawada N, Okuda N, Suhara Y, Uchino Y, Kimoto T, Funahashi N, Kamao M, Tsugawa N, Okano T. Functional characterization of the vitamin K2 biosynthetic enzyme UBIAD1. PLoS One. 2015 Apr 15;10(4):e0125737. doi: 10.1371/journal.pone.0125737. PMID: 25874989; PMCID: PMC4398444.
-
Schurgers LJ, Teunissen KJ, Hamulyák K, Knapen MH, Vik H, Vermeer C. Vitamin K-containing dietary supplements: comparison of synthetic vitamin K1 and natto-derived menaquinone-7. Blood. 2007 Apr 15;109(8):3279-83. doi: 10.1182/blood-2006-08-040709. Epub 2006 Dec 7. PMID: 17158229
-
Takeuchi, A., et al. “Minimal effective dose of vitamin K2 (menaquinone-4) on serum osteocalcin concentration in Japanese subjects and safety evaluation of vitamin K2 supplemented in calcium tablet.” J Jpn Soc Clin Nutr 26 (2005): 254-260.
-
Sato, Toshiro et al. “Comparison of menaquinone-4 and menaquinone-7 bioavailability in healthy women.” Nutrition journal vol. 11 93. 12 Nov. 2012, doi:10.1186/1475-2891-11-93.
-
Nakamura E, Aoki M, Watanabe F, Kamimura A. Low-dose menaquinone-4 improves γ-carboxylation of osteocalcin in young males: a non-placebo-controlled dose-response study. Nutr J. 2014 Aug 27;13:85. doi: 10.1186/1475-2891-13-85. PMID: 25163392; PMCID: PMC4155127.
-
Schurgers LJ, Vermeer C. Differential lipoprotein transport pathways of K-vitamins in healthy subjects. 2002; 1570: 27-32.
-
Binkley NC, Krueger DC, Kawahara TN, et al. A high phylloquinone intake is required to achieve maximal osteocalcin gamma-carboxylation. Am J Clin Nutr. 2002;76(5):1055–1060.
-
Knapen MH, Braam LA, Drummen NE, Bekers O, Hoeks AP, Vermeer C. Menaquinone-7 supplementation improves arterial stiffness in healthy postmenopausal women. A double-blind randomised clinical trial. Thromb Haemost. 2015;113(5):1135–1144. https://doi.org/10.1160/ TH14-08-0675. Epub 2015 Feb 19. PubMed PMID: 25694037.
-
Fulton RL, McMurdo ME, Hill A, et al. Effect of vitamin K on vascular health and physical function in older people with vascular disease—a randomised controlled trial. J Nutr Health Aging. 2016;20(3):325–333. https://doi.org/10.1007/s12603-015-0619 PubMed PMID: 26892582.
-
Theuwissen E, Cranenburg EC, Knapen MH, et al. Low-dose menaquinone-7 supplementation improved extra-hepatic vitamin K status, but had no effect on thrombin generation in healthy subjects. Br J Nutr. 2012;108(9):1652–1657. https://doi.org/10.1017/S0007114511007185. Epub 2012 Jan 31. PubMed PMID: 22289649.]
-
Shea MK, O’Donnell CJ, Vermeer C, et al. Circulating uncarboxylated matrix gla protein is associated with vitamin K nutritional status, but not coronary artery calcium, in older adults. J Nutr. 2011;141(8):1529–1534. https://doi.org/10.3945/jn.111.139634 Epub 2011 May 31. PubMed PMID: 21628633; PubMed Central PMCID: PMC3138643.]
-
Dalmeijer GW, van der Schouw YT, Magdeleyns E, Ahmed N, Vermeer C, Beulens JW. The effect of menaquinone-7 supplementation on circulating species of matrix Gla protein. Atherosclerosis. 2012;225(2):397–402. https://doi.org/10.1016/j.atherosclerosis.2012.09.019 Epub 2012 Sep 25. PubMed PMID: 23062766]
-
Brandenburg VM, Reinartz S, Kaesler N, et al. Slower progress of aortic valve calcification with vitamin K supplementation: results from a prospective interventional proof-of-concept study. Circulation. 2017;135(21):2081–2083. https://doi.org/10.1161/CIRCULATIONAHA.116.027011 PubMed PMID: 28533322.]
-
Joyce C McCann, Bruce N Ames, Vitamin K, an example of triage theory: is micronutrient inadequacy linked to diseases of aging?, The American Journal of Clinical Nutrition, Volume 90, Issue 4, October 2009, Pages 889–907, https://doi.org/10.3945/ajcn.2009.27930
-
Geleijnse JM, Vermeer C, Grobbee DE, Schurgers LJ, Knapen MH, van der Meer IM, Hofman A, Witteman JC: Dietary intake of menaquinone is associated with a reduced risk of coronary heart disease: the Rotterdam Study. J Nutr. 2004 Nov; 134(11): 3100-3105.
-
Beulens JW, Bots ML, Atsma F, Bartelink ML, Prokop M, Geleijnse JM, Witteman JC, Grobbee DE, van der Schouw YT. High dietary menaquinone intake is associated with reduced coronary calcification. Atherosclerosis. 2009 Apr;203(2):489-93.
-
Erkkilä AT, Booth SL, Hu FB, et al. Phylloquinone intake as a marker for coronary heart disease risk but not stroke in women. Eur J Clin Nutr. 2005;59(2):196–204. PubMed PMID: 15454972)
-
Juanola-Falgarona M, Salas-Salvadó J,et. al. Dietary intake of vitamin K is inversely associated with mortality risk. J Nutr. 2014;144(5):743–750. https://doi.org/10.3945/jn.113.187740. Epub 2014 Mar 19. Erratum in: J Nutr. 2016 Mar;146(3):653. PubMed PMID: 24647393
-
Binkley N, Harke J, Krueger D, et al. Vitamin K treatment reduces undercarboxylated osteocalcin but does not alter bone turnover, density,or geometry in healthy postmenopausal North American women. J Bone Miner Res. 2009;24(6):983–991
-
Kanellakis S, Moschonis G, Tenta R, et al. Changes in parameters of bone metabolism in postmenopausal women following a 12-month intervention period using dairy products enriched with calcium, vitamin D, and phylloquinone (vitamin K(1)) or menaquinone-7 (vitamin K (2)): the Postmenopausal Health Study II. Calcif Tissue Int. 2012;90(4):251–262. https://doi.org/10.1007/s00223-012-9571-z Epub 2012 Mar 4. PubMed PMID: 22392526.
-
Iwamoto et al.: High-dose vitamin K supplementation reduces fracture incidence in postmenopausal women: a review of the literature. Nutrition Research 29 (2009) 221–228
-
Hao G, Zhang B, Gu M, et al. Vitamin K intake and the risk of fractures: A meta-analysis. Medicine (Baltimore). 2017;96(17):e6725. doi:10.1097/MD.0000000000006725
-
Shea MK, Dallal GE, Dawson-Hughes B, et al. Vitamin K, circulating cytokines, and bone mineral density in older men and women. Am J Clin Nutr. 2008;88(2):356–363.
-
Walther B, Karl JP, Booth SL, Boyaval P. Menaquinones, bacteria, and the food supply: the relevance of dairy and fermented food products to vitamin K requirements.
-
Braam LA, Knapen MH, Geusens P, Brouns F, Vermeer C. Factors affecting bone loss in female endurance athletes: a two-year follow-up study. Am J Sports Med. 2003;31(6):889–895. PubMed PMID: 14623654.
-
Sato Y, Nakamura R, Satoh M, et al. Thyroid hormone targets matrix Gla protein gene associated with vascular smooth muscle calcification. Circ Res. 2005;97(6):550–557.
-
Harshman SG, Saltzman E, Booth SL. Vitamin K: dietary intake and requirements in different clinical conditions. Curr Opin Clin Nutr Metab Care. 2014;17(6):531–538. https://doi.org/10.1097/MCO.0000000000000112. Review. PubMed PMID: 25232640
-
Iwamoto J, Sato Y. Menatetrenone for the treatment of osteoporosis. Expert Opin Pharmacother. 2013 Mar;14(4):449-58. doi: 10.1517/14656566.2013.763796. Epub 2013 Jan 25. Retraction in: Expert Opin Pharmacother. 2019 Aug;20(12):1531. PMID: 23346882.]
-
Knapen MH, Schurgers LJ, Vermeer C. Vitamin K2 supplementation improves hip bone geometry and bone strength indices in postmenopausal women. Osteoporos Int. 2007;18(7):963–972.
-
Ushiroyama T, Ikeda A, Ueki M. Effect of continuous combined therapy with vitamin K(2) and vitamin D(3) on bone mineral density and coagulofibrinolysis function in postmenopausal women. Maturitas. 2002;41(3):211–221.
-
Orimo H, Shiraki M, Tomita A, Morii H, Fujita T, Ohata M. Effects of menatetrenone on the bone and calcium metabolism in osteoporosis: a double‐ blind placebo‐controlled study. J Bone Miner Metab, 1998. 16: 106–112.: Megj.: napi 90 mg nem csak lassítani vagy megállítani tudta, de vissza is fordítani a csontritkulást (+2% BMD). 80 fő
-
Shiraki M, Shiraki Y, Aoki C, Miura M . Vitamin K2 ( menatetrenone) effectively prevents fracture and sustains lumbar bone mineral density in osteoporosis. J Bone Miner Res, 2000. 15: 515–521. Megj.: Bár BMD-t nem tudta növelni, de töréskockázatot kb felére csökkentette
-
Iwamoto J, Takeda T, Ichinura S. Effect of combined administration of vitamin D3 and vitamin K2 on bone mineral density of the lumbar spine in postmenopausal women with osteoporosis. J Orthop Sci, 2000. 5: 546–551.
-
Iwamoto J, Takeda T, Ichmura S. Treatment with vitamin D3 and/or vitamin K2 for postmenopausal osteoporosis. Keio J Med, 2003. 52: 147–150.
-
Iwamoto J, Takeda T, Ichimura S. Effect of menatetrenone on bone mineral density and incidence of vertebral fractures in postmenopausal women with osteoporosis: a comparison with the effect of etidronate. J Orthop Sci. 2001; 6(6): 487–492. Megj.: Nem csökkentette töréskockázatot, BMD-t enyhén mérsékelte, de nem növelte
-
Iwamoto J, Takeda T, Ishmura S. Combined treatment with K2 and bisphosphonate in postmenopausal women with osteoporosis. Yonsei Med J, 2003. 44: 751-756. Megj.: Etidronate gyógyszerrel együtt az MK-4 hatásosabban fokozta BMD-t, mint az etidronate külön. Önmagában az MK-4 nem fokozta, de segített lassítani a romlását.
-
Iwamoto J. Vitamin K2 therapy for postmenopausal osteoporosis. Nutrients, 2014. 6: 1971–1980. Megj.: Etidronate gyógyszerrel együtt az MK-4 hatásosabban fokozta BMD-t, mint az etidronate külön. Önmagában az MK-4 nem fokozta, de segített lassítani a romlását.
-
Ishida Y and Kawai S. Comparative efficacy of hormone replacement therapy, etidronate, calcitonin, alfacalcidol, and vitamin K in postmenopausal women with osteoporosis: The Yamaguchi Osteoporosis Prevention Study. Am J Med, 2004. 117(8): 549–555.: Megj.:Etidronatenál kevésbé, de így is kb felére csökk törés kock.
-
Je SH, Joo NS, Choi B h, Kim KM, Kim BT, Park SB, Cho DY, Kim KN, Lee DJ. Vitamin K supplement along with vitamin D and calcium reduced serum concentration of undercarboxylated osteocalcin while increasing bone mineral density in Korean postmenopausal women over sixty years old. J Korean Med Sci, 2011. 26(8): 1093–1098. Megj.:Enyhe hatás 4-ből 1helyen javított BMD-n, máshol nem.
-
Emaus N, Gjesdal CG, Almås B, et al. Vitamin K2 (MK-7) supplementation does not influence bone loss in early menopausal women: a randomised double-blind placebo-controlled trial. Osteoporos Int. 2010;21(10):1731–1740. https://doi.org/10.1007/s00198-009-1126-4. Epub 2009 Nov 25. PubMed PMID: 19937427.
-
Knapen MH, Drummen NE, Smit E, Vermeer C, Theuwissen E. Threeyear low-dose menaquinone-7 supplementation helps decrease bone loss in healthy postmenopausal women. Osteoporos Int. 2013;24(9):2499– https://doi.org/10.1007/s00198-013-2325-6. Epub 2013 Mar 23. PubMed PMID: 23525894.
-
Rønn SH, Harsløf T, Pedersen SB, Langdahl BL. Vitamin K2 (menaquinone-7) prevents age-related deterioration of trabecular bone microarchitecture at the tibia in postmenopausal women. Eur J Endocrinol. 2016;175(6):541–549. Epub 2016 Sep 13. PubMed PMID: 27625301.
-
Vlasschaert C, Goss CJ, Pilkey NG, McKeown S, Holden RM. Vitamin K Supplementation for the Prevention of Cardiovascular Disease: Where Is the Evidence? A Systematic Review of Controlled Trials. Nutrients. 2020;12(10):2909. Published 2020 Sep 23. doi:10.3390/nu12102909 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7598164/
-
Braam LA, Hoeks AP, Brouns F, et al. Beneficial effects of vitamins D and K on the elastic properties of the vessel wall in postmenopausal women: a follow-up study. Thromb Haemost. 2004;91(2):373–380.
-
Shea MK, O’Donnell CJ, Hoffmann U, et al. Vitamin K supplementation and progression of coronary artery calcium in older men and women. Am J Clin Nutr. 2009;89(6):1799–1807.
-
Ikari Y, Torii S, Shioi A, Okano T. Impact of menaquinone-4 supplementation on coronary artery calcification and arterial stiffness: an open label single arm study. Nutr J. 2016;15(1):53. https://doi.org/10.1186/s12937-016-
-
Zwakenberg SR, de Jong PA, Bartstra JW, et al. The effect of menaquinone-7 supplementation on vascular calcification in patients with diabetes: a randomized, double-blind, placebo-controlled trial. Am J Clin Nutr. 2019;110(4):883–890. https://doi.org/10.1093/ajcn/nqz147.
-
Bartstra JW, Draaisma F, Zwakenberg SR, et al. Six months vitamin K treatment does not affect systemic arterial calcification or bone mineral density in diabetes mellitus 2. Eur J Nutr. 2021;60(3):1691-1699. doi:10.1007/s00394-020-02412-z
-
Jamie W Bellinge, Roslyn J Francis, Sing C Lee, Nicola P Bondonno, Marc Sim, Joshua R Lewis, Gerald F Watts, Carl J Schultz, The effect of vitamin K1 on arterial calcification activity in subjects with diabetes mellitus: a post hoc analysis of a double-blind, randomized, placebo-controlled trial, The American Journal of Clinical Nutrition, 2021;, nqab306, https://doi.org/10.1093/ajcn/nqab306
-
Cheung AM, Tile L, Lee Y, Tomlinson G, Hawker G, Scher J, Hu H, Vieth R, Thompson L, Jamal S, Josse R. Vitamin K supplementation in postmenopausal women with osteopenia (ECKO trial): a randomized controlled trial. PLoS Med. 2008 Oct 14;5(10):e196. doi: 10.1371/journal.pmed.0050196. Erratum in: PLoS Med. 2008 Dec;5(12):e247. PMID: 18922041; PMCID: PMC2566998.
-
Lamson DW, Plaza SM. The anticancer effects of vitamin K. Altern Med Rev. 2003;8(3):303–318. Review.
-
Carr BI, Wang Z, Wang M, et al. Differential effects of vitamin K1 on AFP and DCP levels in patients with unresectable HCC and in HCC cell lines. Dig Dis Sci. 2010.
-
Mizuta T, Ozaki I, Eguchi Y, et al. The effect of menatetrenone, a vitamin K2 analog, on disease recurrence and survival in patients with hepatocellular carcinoma after curative treatment: a pilot study. Cancer. 2006;106(4):867–872.]
-
Abe Y, Muta K, Hirase N, et al. Vitamin K2 therapy for myelodysplastic syndrome. Rinsho Ketsueki. 2002;43(2):117–121